Udforskning af emodins virkningsmekanisme ved behandling af sepsisrelateret akut nyreskade baseret på datamining og eksperimentel verifikation
Sepsis er en livstruende organdysfunktion forårsaget af en ubalance i værtens reaktion på infektion. Nyrerne er et af de hyppigst ramte organer ved sepsis, og sepsisassocieret akut nyreskade (SA-AKI) bliver ofte den direkte dødsårsag hos sepsispatienter med en høj dødelighed, hvilket stiller kliniske læger over for hidtil usete udfordringer. AKI varer ved og øger den potentielle risiko for kronisk nyresygdom (CKD). Patienter, der overlever, udvikler sig ofte uundgåeligt til nyresygdom i slutstadiet (ESRD), hvilket udgør en alvorlig trussel mod deres livskvalitet og sikkerhed.
Desværre er den nuværende evne til at forebygge og behandle SA-AKI meget begrænset. Aktiv væskebaseret terapi har muligvis ikke pålidelig evidensbaseret medicin og kan endda være skadelig. Brugen af vasoaktive lægemidler til at opretholde blodtrykket kræver en balance mellem den store cirkulation og mikrocirkulationen, og der er ingen konsensus om, hvor meget blodtryk der skal opretholdes for at hjælpe med at forhindre forekomsten af AKI. Hvis nyreforebyggelse mislykkes, skal der anvendes nyreerstatningsterapi (RRT) til behandling, men den optimale timing og metode til RRT-intervention er ikke klar. Hvis SA-AKI-patienter overlever, vil de fleste patienters nyrefunktion komme sig, men man ved ikke meget om mekanismerne for reparation af nyrerne eller manglende reparation af nyrefunktionen, og den livslange risiko for progression til CKD og ESRD er højere. Indtil videre er der ikke noget bestemt og pålideligt lægemiddel til behandling af AKI. De konventionelle kliniske behandlingsforanstaltninger er hovedsageligt nyreerstatning og symptomatisk omfattende behandling. Reparation af nyrefunktionen afhænger af pålidelig støtte til selve nyren i kroppen som helhed. Derfor har udforskning af lægemidler eller foranstaltninger, der effektivt kan forebygge eller behandle SA-AKI på en tidlig og rettidig måde, undgå forekomsten af kronisk nyresygdom eller fremme nyrereparation, vigtig klinisk værdi for at reducere dødeligheden hos sepsispatienter og forbedre livskvaliteten for overlevende patienter.
Emodin er en naturlig forbindelse, der udvindes af kinesiske urter som rabarber og Polygonum cuspidatum, som har forskellige farmakologiske virkninger som antiinflammatorisk, antiviral og antitumor. Tidligere undersøgelser har bekræftet, at emodin har en beskyttende virkning på sepsispatienter; Nylige undersøgelser har vist, at emodin har en beskyttende virkning mod skader forårsaget af oxidativ stress, inflammation og celleapoptose. Det er dog stadig uklart, om emodin kan forbedre prognosen for SA-AKI-patienter. Denne undersøgelse vil udforske de vigtigste gener, der er involveret i patogenesen af SA-AKI gennem biovidenskabsrelaterede databaser, og analysere de inflammatoriske signalveje, der er involveret i disse nøglegener; Desuden blev der udført dyreforsøg for at undersøge, om emodin påvirker den inflammatoriske vej til SA-AKI og dens beskyttende virkning og mekanisme på SA-AKI-rotter, hvilket giver nye ideer til forebyggelse og behandling.



Forskning har vist, at patogenesen af SA-AKI er multifaktoriel og kompleks og involverer et samspil mellem inflammation, mikrocirkulationsdysfunktion og metabolisk omprogrammering. Patofysiologien involverer skade og dysfunktion af flere celletyper. I forbindelse med sepsis frigiver bakterier endotoksiner eller endotoksinlignende stoffer, som aktiverer inflammatoriske celler som neutrofiler, monocytter og endotelceller i kroppen og frigiver en stor mængde endogene inflammatoriske mediatorer i blodbanen. På den ene side forårsager dette skader på flere organer, herunder nyrerne, og på den anden side aktiverer det flere inflammatoriske celler til at deltage i sygdommen og danne et ondartet immunnetværksrespons. I SD-rotte-modellen for lipopolysaccharid (LPS)-induceret SA-AKI lindrer nerolidol SA-AKI ved at hæmme signalvejene NF - κ B og Toll-lignende receptor 4 (TLR4). Det er blevet bekræftet, at TLR4/NF - κ B-vejen er involveret i processen med nyrebetændelsesrespons, og hæmning af TLR4/NF - κ B-medieret inflammatorisk respons har en beskyttende virkning på LPS-induceret AKI. Det kan ses, at inflammatorisk respons er en vigtig mekanisme i patogenesen af SA-AKI, og at hæmning af den inflammatoriske responsvej er en vigtig behandlingsmulighed for sepsis, hvilket giver nye ideer til den kliniske behandling af SA-AKI-patienter.
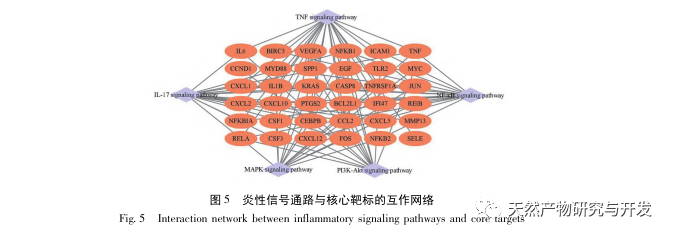
Denne undersøgelse brugte en biologisk database til at analysere 2801 vigtige mål, der er involveret i patogenesen af SA-AKI. KEGG-analyse af disse mål afslørede i alt 5 vigtige signalveje for inflammatorisk respons, blandt hvilke TNF-signalvejen og IL-17-signalvejen rangerede højt, og NF - κ B-signalvejen fungerede som et knudepunkt for begge veje til at deltage i patogenesen af SA-AKI. I TNF-signalvejen er TNF - α ikke kun den vigtigste opstrømsaktivator for NF - κ B-signalering, men fungerer også som et nedstrøms responsivt molekyle i NF - κ B-signalvejen, hvilket tyder på, at det fremmer NF - κ B-signalvejen gennem positiv feedback, og de to supplerer hinanden. I IL-17-signalvejen er IL-17A den vigtigste initierende faktor i IL-17-familien, og Th17-celler er dens vigtigste udskillende celler. I den CLP-inducerede model viste det sig, at IL-17A er stærkt udtrykt i bughulen og spiller en nøglerolle i det inflammatoriske respons efter svær sepsis. Neutralisering af IL-17A i bughulen kan reducere produktionen af pro-inflammatoriske cytokiner. I mellemtiden har undersøgelser vist, at Toll like receptor 9 (TLR9) i dendritiske celler (DC'er) kan spille en nøglerolle i udviklingen af SA-AKI ved at formidle IL-17A-produktion af gamma delta T-celler; Andre undersøgelser har vist, at knock-out af IL-17A kan forhindre SA-AKI. Ovenstående indikerer, at TNF - α og IL-17A er pro-inflammatoriske faktorer i sepsis, og TNF-signalvejen og IL-17-signalvejen er bredt involveret i forekomsten og udviklingen af sepsis, hvilket er i overensstemmelse med dataanalysens resultater.
Der har været mange undersøgelser af behandling af sepsis med emodin, hovedsageligt med fokus på hjerne-, blod-, hjerte-, tarm- og lungevæv. Ved sepsisassocieret encefalopati (SAE) kan emodin forbedre kognitiv svækkelse og patologisk skade og hæmme CLP-induceret inflammation hos mus ved at opregulere BDNF/TrkB-signalering. I blodsystemet nedregulerer emodin P-selectin, forbedrer blodpladetallet og aggregeringsevnen i den sene fase af sepsis og forbedrer endogen koagulationsfaktoraktivitet og fibrinogenfunktion og udøver antiinflammatoriske virkninger. Ved septisk kardiomyopati har det vist sig, at emodin kan vende hjertedysfunktion og forbedre myokardietilstanden hos septiske rotter, hvilket kan være relateret til dets hæmning af inflammasomaktivering. Ved sepsis-induceret tarmskade kan emodin forbedre tarmslimhindeskade ved at reducere niveauerne af inflammatoriske faktorer og oxidative stressmarkører, og dens virkningsmekanisme kan være relateret til VDR/Nrf2/HO-1-vejen; Og ved at øge ekspressionsniveauet af tight junction (TJ) protein beskytter det tarmbarrierens integritet og hæmmer tarmbarrierens permeabilitet. Ud over at forbedre tarmens inflammatoriske respons og barrierefunktion kan emodin også forhindre forskydning af Escherichia coli, forhindre spredning og overførsel af bakterier og reducere den sekundære skade forårsaget af bakterier. Ved sepsisrelateret akut lungeskade kan emodin hæmme NF - κ B og high mobility group box 1 (HMGB1) veje og derved reducere pulmonal oxidativ stress og inflammatorisk respons. En anden undersøgelse af lungerne er baseret på autofagi-vejen, og interventionen af emodin kan effektivt forhindre progression af akut lungeskade. Desuden har andre undersøgelser vist, at emodin effektivt kan lindre lungevævsødem i sepsisinduceret akut lungeskade ved at regulere aquaporin (AQP), TJ, inflammatoriske faktorer og lungecelleapoptose. Undersøgelsen af emodin på SA-AKI er endnu ikke blevet rapporteret. Gennem denne undersøgelse blev det konstateret, at CLP-modelrotter behandlet med emodin viste nedsat ekspression af TNF - α, IL-17 og IFN - γ i ELISA-resultater, hvilket er i overensstemmelse med den hæmmende virkning af emodin på sepsisinflammation.
Den samme effekt af emodin på den inflammatoriske Th17/Treg-akse er også blevet belyst. I undersøgelsen af akut pancreatitis blev det konstateret, at emodin hæmmer immunresponsen i svær akut pancreatitis ved at regulere forholdet mellem IFN - γ / IL-17 og derved lindre tarmbarrieredysfunktion. Og denne undersøgelse viste, at emodin i SA-AKI også kan reducere udtrykket af IL-17A og forbedre dets inflammatoriske respons.
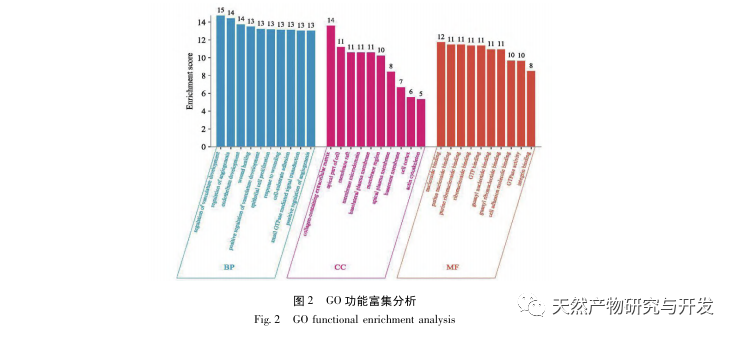
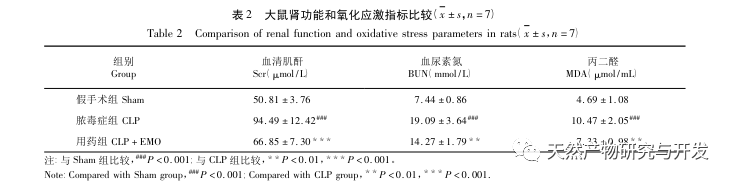
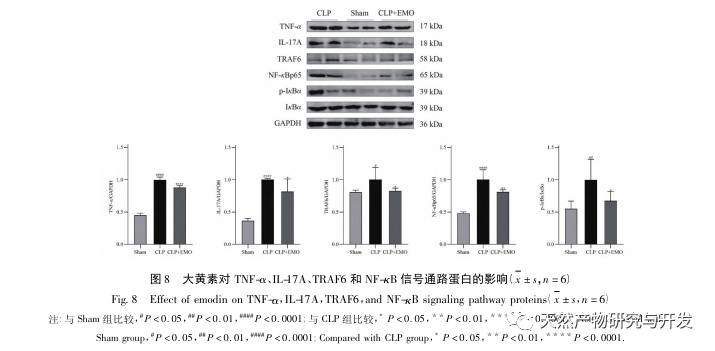
Sammenfattende har denne undersøgelse identificeret 2801 nøglegener, der er involveret i patogenesen af emodin gennem datamining. GO-biologisk procesanalyse antyder, at de biologiske funktioner af disse mål hovedsageligt involverer membransignaltransduktion, vaskulær regulering og sårheling. KEGG-vejberigelsesanalyse viste, at TNF, IL-17, PI3K Akt, NF - κ B og MAPK-signalveje blev beriget i inflammationsrelaterede signalveje. Eksperimentel verifikation viste, at behandlingen med emodin forbedrede nyrefunktionen i SA-AKI, og niveauerne af oxidativ stress (MDA) og inflammatoriske cytokiner (TNF - α, IL-17 og IFN - γ) faldt. Proteinudtrykket af IL-17A, TNF - α, TRAF6, NF - κ Bp65 og fosforyleringsniveauet af I κ B α blev signifikant reduceret sammenlignet med CLP-gruppen, hvilket er i overensstemmelse med dataanalysens resultater. Det antydes, at emodin kan forbedre SA-AKI hos rotter, hvilket kan være relateret til IL-17/NF - κ B og TNF/NF - κ B-signalvejene.
