Computersimuleringsevaluering af lipasehæmmende peptider fra bugspytkirtlen i kamelblodprotein
I de senere år er hyperlipidæmi (HLP) med forbedringen af folks levestandard og ændringer i kostvaner gradvist blevet den "største dræber", der bringer menneskers sundhed i fare. Denne sygdom er forårsaget af dysregulering af lipidmetabolismen i kroppen. I betragtning af det tætte forhold mellem kolesterolabsorption og lipidmetabolisme er kolesterolabsorptionsvejen blevet et vigtigt interventionsmål for behandling af hyperlipidæmi, som effektivt kan forhindre hyperlipidæmi ved at reducere absorptionen af kolesterol i tarmen. De lipider, der indtages fra kosten, hydrolyseres først af bugspytkirtellipase, nedbrydes til fedtsyrer og monoglycerider, danner miceller med kolesterol, galdesalte osv. og absorberes til sidst af celler i tarmen. Derfor kan effektiv hæmning af pancreaslipase (PL)-aktiviteten reducere kroppens absorption af lipider, lindre tilstanden fra kilden og forebygge sygdomme. Nogle lægemidler på markedet har visse bivirkninger, der kan forårsage ubehag hos patienterne. Derfor haster det med at udvikle naturligt forekommende bioaktive stoffer til at hjælpe med behandlingen af hyperlipidæmi.
Bioaktive peptider er blevet et hotspot for forskningen i de senere år på grund af deres brede kilder og høje sikkerhedsfaktor. Kamelblod har et højt proteinindhold med et samlet proteinindhold på 6,80 g/dL og et hæmoglobinindhold på 141,11 g/L, hvilket er højere end hos andre husdyr. Det har også et rigt udvalg af aminosyrer, der opfylder de anbefalede værdier fra WHO/FAO/UNU, og er en potentiel kilde til bioaktive peptider af høj kvalitet. Og forskning har vist, at proteasehydrolysater fra kamelblod har anti-trætheds-, antioxidant- og blodtrykssænkende effekter. Derfor har fremstillingen af pankreaslipasehæmmende peptider fra kamelblodprotein en vis forskningsværdi.
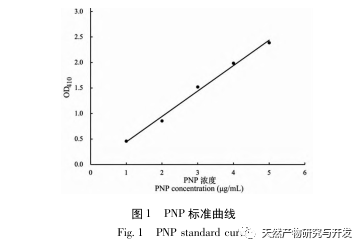
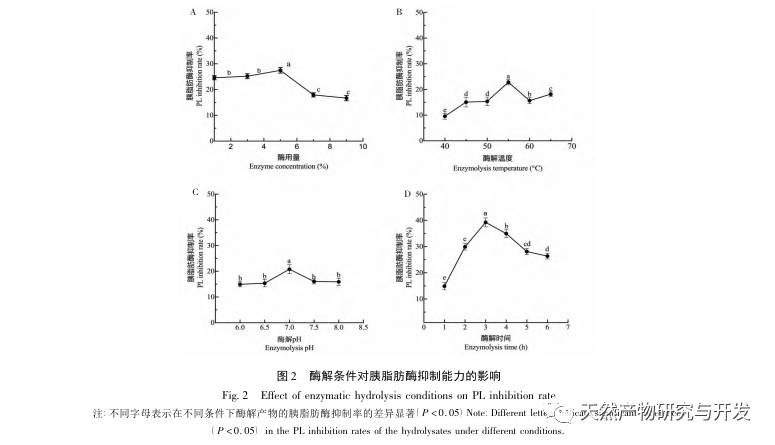
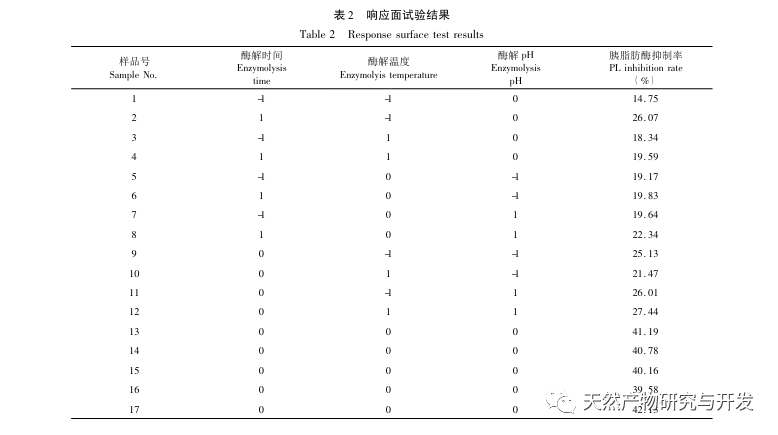
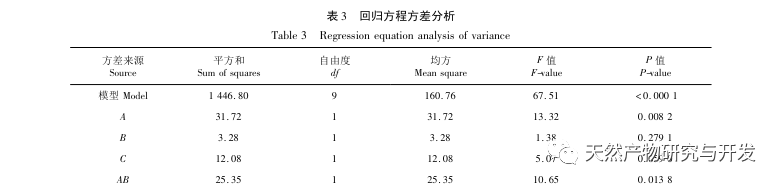
I denne undersøgelse blev neutral protease brugt til at hydrolysere kamelblodprotein, og pankreaslipasehæmning blev brugt som evalueringsindeks til at optimere den enzymatiske hydrolyseproces. Matrixassisteret laserdesorption/ioniseringsflyvetidsmassespektrometri (MALDI-TOF-MS) blev brugt til at bestemme molekylvægtfordelingen af kamelblodpeptider, og væskekromatografimassespektrometri (LC-MS) blev brugt til at identificere og analysere kamelblodpeptider. PepSite2 blev brugt til at modellere og forudsige bindingssteder, og molekylær dynamiksimulering blev brugt til at evaluere bindingsstederne og virkemåderne for de screenede peptider, hvilket giver et grundlag for identifikation og analyse af kamelblodpeptider i fremtiden. Undersøgelsen af lipasehæmmende peptider giver reference og nye ideer til udvikling og udnyttelse af kamelblod.
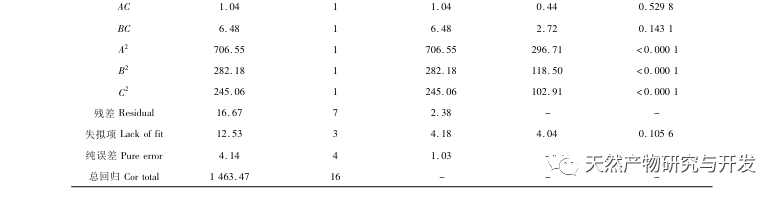
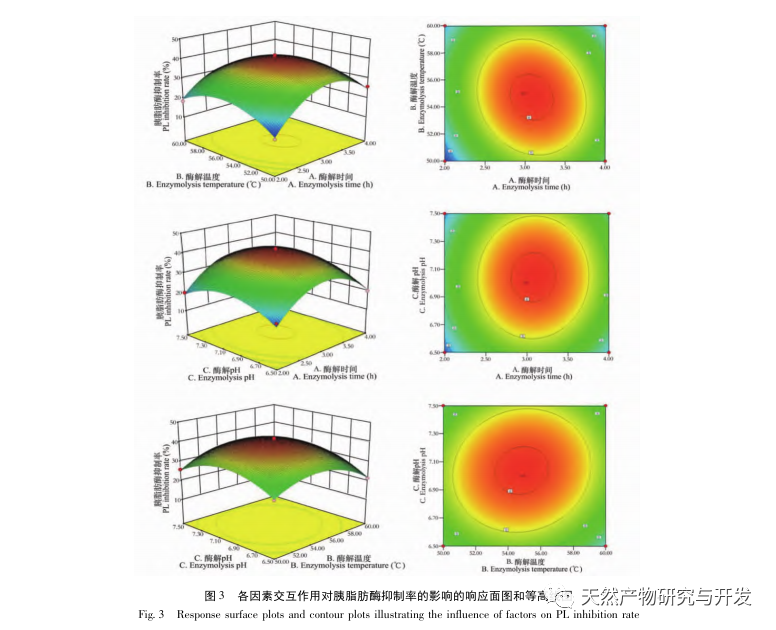
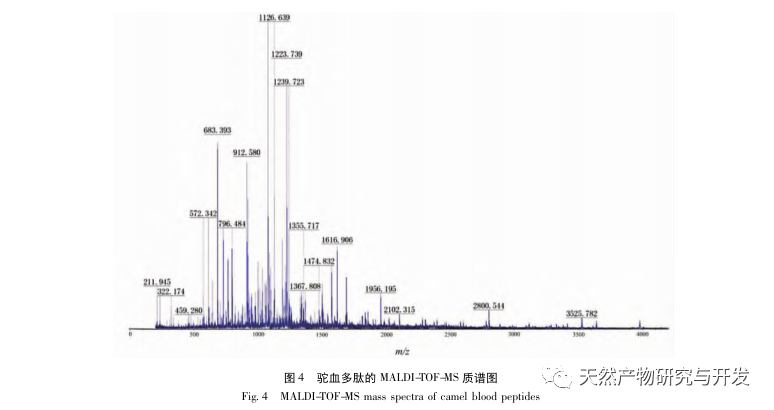


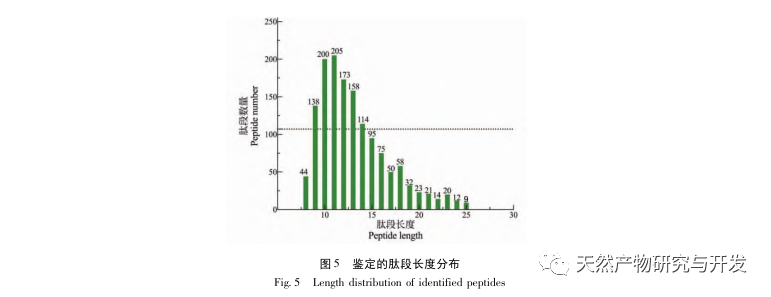
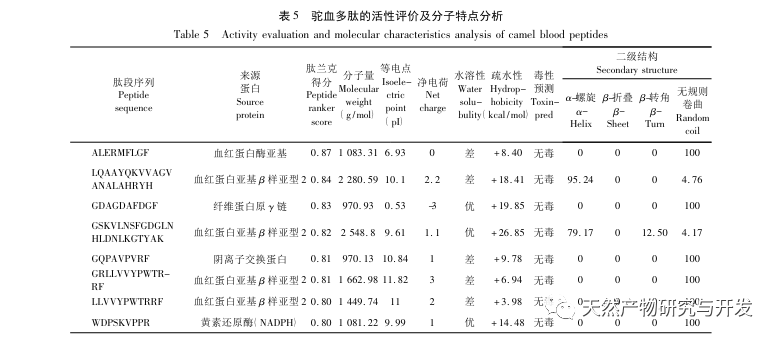

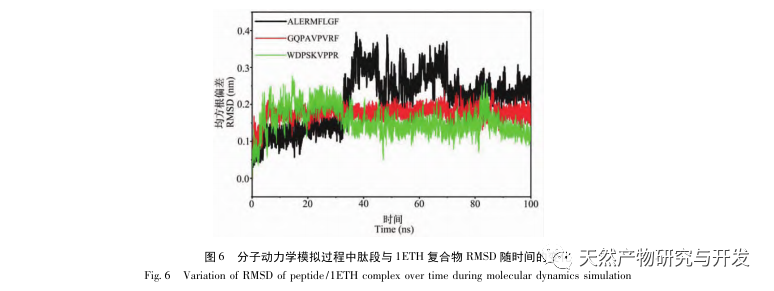
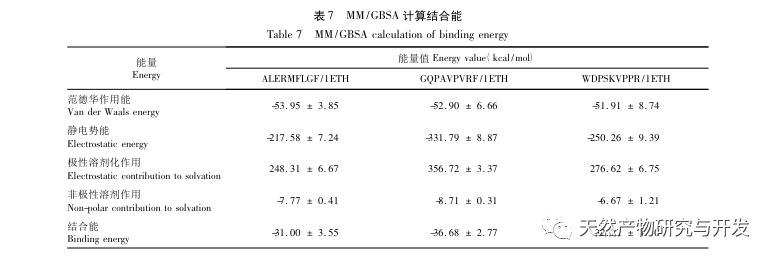
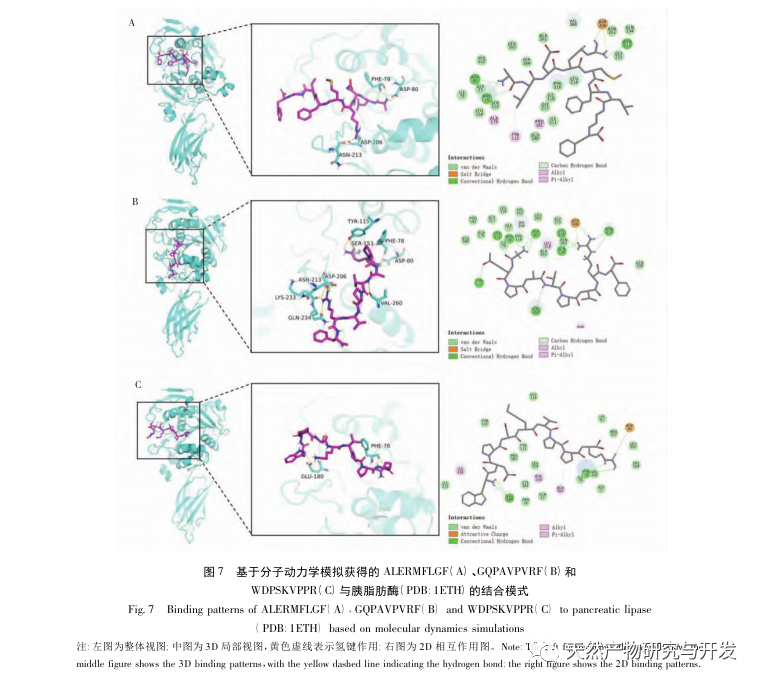
Hæmning af bugspytkirtellipase anses for at være et af de vigtigste terapeutiske indgreb mod hyperlipidæmi og fedme. Denne undersøgelse optimerede processen med at fremstille kamelblodpancreaselipasehæmmende peptider ved neutral proteasehydrolyse baseret på pancreaslipasehæmmende aktivitet gennem enkeltfaktor- og responsoverfladeeksperimenter. Under optimale forhold var kamelblodpeptidets hæmning af bugspytkirtellipase 42,13%. Ved at analysere de enzymatiske hydrolyseprodukter ved hjælp af MALDI-TOF-MS, LC-MS og bioinformatik-teknologi blev tre peptidsegmenter, ALERMFLGF, GQPAVPVRF og WDPSKVPPR, identificeret som signifikant bindende for pancreaslipase. Gennem molekylære dynamiksimuleringer blev det konstateret, at de tre peptidsegmenter hovedsageligt binder sig til aminosyreresterne på det aktive PL-sted gennem hydrogenbinding og hydrofobe interaktioner, hvilket forstyrrer funktionen af den pancreatiske lipases N-terminale domæneventil og hæmmer dens aktivitet. Blandt dem har GQPAVPVRF en høj bindingsfri energi og et stort antal hydrogenbindinger inden for 100ns, hvilket betyder, at den kan binde tæt til 1ETH og forventes at blive en komponent i pankreaslipasehæmmere. Forskningsresultaterne viser, at kamelblodprotein kan fungere som en kilde til lipasehæmmende peptider i bugspytkirtlen. Der er dog visse begrænsninger for resultaterne af den virtuelle screening, og i fremtiden er det nødvendigt at optimere peptidsegmenternes vandopløselighed og fordøjelsesstabilitet. Efter kunstig syntese bør den antihyperlipidemiske effekt verificeres gennem in vitro- og in vivo-eksperimenter.
